Journal of Applied Biosciences 209: 22158 – 22170
ISSN 1997-5902
Evaluation de l’effet gastro protecteur et des potentialités antioxydantes des extraits de feuilles de Mitragyna inermis (Kuntze) utilisées dans le traitement de l’ulcère gastrique en Côte d’Ivoire
Monon KONE1*, Armel Arsène BONI1, Yao Yves KOUAME1, Landry Sylvain KOUAKOU3, Foussiata TRAORE1, Ahmont Landry Claude KABLAN2, Karamoko OUATTARA4
1Departement de Biochimie-Génétique, UFR Sciences Biologiques, Université Peleforo Gon Coulibaly, BP 1328 Korhogo, Korhogo, Côte d’Ivoire.
2Département de Mathématiques-Physique-Chimie, UFR Sciences Biologiques, Université Peleforo Gon Coulibaly, BP 1328 Korhogo, Korhogo, Côte d’Ivoire.
3Laboratoire de Pharmacologie, Pharmacie Clinique et thérapeutique, UFR des Sciences Pharmaceutiques et Biologiques, Université Félix Houphouët-Boigny, 22 BP 582 Abidjan 22, Côte d’Ivoire.
4Département de Microbiologie et de Biologie Moléculaire, UFR Agriculture, Ressources Halieutiques et Agro-industrie, Université de San Pedro, San Pedro, Côte d’Ivoire.
(*) : Auteur de correspondance : konemonon2017@gmail.com / Cel : +2250707387569/ 0554986598
Submitted 17/04/2025, Published online on 30/06/2025 in the https://www.m.elewa.org/journals/journal-of-applied-biosciences https://doi.org/10.35759/JABs.209.5
Objectif : La présente étude vise à contribuer à la lutte contre l’ulcère gastrique par l’usage des plantes médicinales. Cette étude s’est intéressée à Mitragyna inermis (Djun) une plante médicinale de la famille des Rubiaceae, largement utilisée en médecine traditionnelle ivoirienne dans la prise en charge de l’ulcère gastrique.
Méthodologie et résultats : La détection des constituants phytochimiques et l’évaluation des potentialités antioxydantes ont été réalisées sur plaques CCM. L’effet gastro protecteur a été évalué in vivo sur des souris à des doses de 100 et 200 mg/kg de poids corporel. Tous les extraits ont inhibé le radical DPPH et ont montré une bonne protection de la muqueuse gastrique des souris. Le meilleur pourcentage de protection (92,84±2,20%) a été obtenu avec l’extrait éthanolique à la dose de 100 mg/kg supérieur à celui de sucralfate (90,09±2,31 %.) et de l’oméprazole (75,92 ± 3,56%) deux molécules de références ayant des effets gastro protecteur.
Conclusion et application des résultats : Les analyses expérimentales ont montré que M. inermis contient divers composés phytochimiques notamment, des polyphénols, flavonoïdes, tanins, alcaloïdes, acides phénoliques et des coumarines dont les effets bénéfiques pour l’organisme sont avérés. Ces composés phytochimiques pourraient être à l’origine des potentialités antioxydantes et de la bonne protection de la muqueuse gastrique observé au niveau des souris. L’activité antioxydante de cette plante pourrait lui conférer un pouvoir anti-ulcéreux. Les extraits aqueux et à l’éthanol 70 % des feuilles de M. inermis pourraient être de bons candidats dans la lutte contre les maladies liées au stress oxydatif et à ulcère gastrique. Ces résultats pourraient justifier l’usage des feuilles de cette plante, dans la prise en charge des maladies gastrique en médecine traditionnel en Côte d’Ivoire.
Mots clés : Mitragyna inermis; gastro protecteur ; antioxydante, ulcère, phytothérapie,
Evaluation of the gastroprotective effect and antioxidant potential of Mitragyna inermis (Kuntze) leaf extracts used in the treatment of gastric ulcer in Côte d’Ivoire.
ABSTRACT
Objective : The present study aims to contribute to the fight against gastric ulcer through the use of medicinal plants. This study focused on Mitragyna inermis, a medicinal plant of the Rubiaceae family, widely used in traditional Ivorian medicine for the treatment of gastric ulcer.
Methodology and results: Detection of phytochemical constituents and evaluation of antioxidant potential were carried out on TLC plates. The gastroprotective effect was evaluated in vivo on mice at doses of 100 and 200 mg/kg body weight. All extracts inhibited the DPPH radical and showed good protection of the mice’s gastric mucosa. The best percentage of protection (92.84±2.20%) was obtained with the ethanolic extract at a dose of 100 mg/kg, superior to sucralfate (90.09±2.31%) and omeprazole (75.92±3.56%), two reference molecules with gastroprotective effects.
Conclusion and application of results: Experimental analyses have shown that M. inermis contains various phytochemical compounds, notably polyphenols, flavonoids, tannins, alkaloids, phenolic acids and coumarins, with proven beneficial effects for the organism. These phytochemicals may be responsible for the antioxidant potential and good protection of the gastric mucosa observed in mice. The plant’s antioxidant activity could give it anti-ulcer properties. Aqueous and 70% ethanol extracts of M. inermis leaves could be good candidates in the fight against diseases linked to oxidative stress and gastric ulcers. These results could justify the use of this plant’s leaves in the treatment of gastric diseases in traditional medicine in Côte d’Ivoire.
Key words : Mitragyna inermis ; gastroprotective; antioxidant, ulcer, phytotherapy, Côte d’Ivoire.
L’ulcère gastrique, également appelé ulcère de l’estomac, est l’un des désordres gastro-intestinaux les plus répandus. C’est une affection chronique, multifactorielle qui se produit en raison d’un déséquilibre entre les facteurs agresseurs et les facteurs de défense de la muqueuse gastrique (Bouchama et al., 2023). Ce déséquilibre inclut, des agresseurs endogènes et exogènes notamment, l’acide chlorhydrique, la pepsine, les espèces réactives de l’oxygène (Serafim et al., 2020), l’infection à Helicobacter pylori (Doffou et al., 2020), le stress, l’alcool, l’ingestion des anti-inflammatoires non stéroïdiens et le tabagisme (Serafim et al., 2020). La bactérie Helicobacter pylori reste la principale cause microbienne des ulcères gastriques avec une prévalence d’infection de 20 à 40 % dans les pays sous-développés et constitue ainsi un véritable problème de santé publique (Werme et al., 2015). Les médicaments synthétiques tels que les inhibiteurs de la pompe à proton (omeprazole), les agents cytoprotecteur, les anticholinergiques, et les antiacides sont les plus employés dans la prise en charge de l’ulcère gastro duodénale (Yousef et al.,2021 Laine et al.,2023). Ces traitements présentent d’énormes limites allant des impasses thérapeutiques à l’apparition d’effet secondaires graves (Koyyada, 2021). Un traitement couplé, utilisant, des antiacides, des antibiotiques et des molécules a effet gastro protecteur pourrait apporter des solutions définitives aux ulcères gastro duodénaux. La recherche de nouvelles molécules naturelles à effet gastro protecteur est plus que nécessaire. Des travaux relatifs aux actions pharmacologiques de Mitragyna inermis attirent toute notre attention. En effet M. inermis est très utilisée par les guérisseurs, mais diversement selon les accès géoculturels. Les écorces sont souvent prescrites pour les états gravido-puerpéraux, les maux de ventre, la dysenterie, la bilharziose, le diabète. C’est un antipaludéen, un antispasmodique, un cardiotonique et anticholestérémique (Toklo et al., 2020). Les parties les plus utilisées sont les feuilles et l’écorce de tronc ou de tige. Ces écorces débarrassées par grattage de l’épiderme et du suber, seraient, après séchage et réduction en poudre, un cicatrisant des grandes plaies et un excellent vulnéraire (Konkon et al., 2006). De nombreuses études ont été réalisées sur cette plante mais l’effet gastro-protecteur reste encore mal connu. C’est donc ce qui motive l’intérêt de cette étude.
MATERIEL ET METHODES
Réactifs et solvants d’extraction : Les révélateurs et réactifs employés pour la détection des composés phytochimiques ayant une activité antioxydante sont : Dragendorff, KOH (5 %), AlCl3 (1 %), FeCl3 (2 %), DPPH, l’eau distillée et l’éthanol 96%. L’omeprazole a été choisi comme molécule standard, pour plusieurs raisons. L’omeprazole est un inhibiteur de la pompe à proton, un anti acide, un anti sécrétoire d’acide gastrique, par conséquent un gastro protecteur de la muqueuse gastrique. En côte d’ivoire, elle fait partir des molécules de premier choix dans le cas d’un ulcère aigue ou chronique.
Matériel biologique : Le matériel végétal est constitué de la poudre des feuilles de Mitragyna inermis (Willd.) O. Ktze. Récoltés à Boyo / Kouto, région de la Bagoué (Nord de la Côte d’Ivoire) et identifiées au Centre National Floristique de l’université Felix Houphouët Boigny d’Abidjan. Le matériel animal est constitué de souris albinos mâles de type Wistar issus de l’animalerie de l’école normale supérieur d’Abidjan ENS, ayant un poids corporel variant entre 26 et 30 g.
Récolte de la plante : Les feuilles de Mitragyna inermis ont été récoltées, ensuite lavées puis séchées à la température du Laboratoire. Les feuilles ont été broyées à l’aide d’un broyeur électrique. La poudre obtenue est récupérée puis stockée dans des bocaux fermés hermétiquement et rangés dans un endroit à l’abri de la lumière et de la chaleur avant son utilisation.
Préparation des extraits totaux : Les extraits totaux ont été obtenus par macération et par décoction. La macération a été réalisé selon la méthode décrite par Zirihi et al. (2003) et la décoction selon Korpe et al. (2013).
Préparation des extraits sélectifs : Les extraits totaux ont servi à la préparation des extraits sélectifs selon Ouattara et al. (2016) en 2016. Une masse de 2 g de chaque extrait a été dissout dans 30 mL d’eau distillée. Un volume de 20 mL de chaque solution préparée a été épuisé par fractionnements successifs avec 10 mL d’hexane (C6H14), 10 mL de dichlorométhane (CH2Cl2) et 10 mL d’acétate éthylique (AcOEt). Les différentes fractions organiques sélectives sont concentrées à l’étuve puis conservées au réfrigérateur à 4°C.
Détection des phytocomposés sur plaque CCM : A l´aide de tubes capillaires, 2 μL de chaque extrait sélectif est déposé sous forme de point et distant de 0,5 cm des deux bords de la plaque chromatographique. Les plaques CCM sont ensuite placées dans la cuve de migration contenant les solvants de migration (développant). Après développement, les chromatogrammes ont été pulvérisés avec des révélateurs visualisés dans le visible et à l’UV 366 nm.
Dépistage des phytocomposés piégeurs du radical DPPH : Le dépistage du pouvoir antioxydant par CCM a été réalisé selon Takao et al. (1994). A l´aide de capillaires, 2 μL de chaque extrait sélectif est déposé sous forme de point et distant de 0,5 cm des deux bords de la plaque chromatographique. Les plaques CCM sont ensuite placées dans la cuve à chromatographie saturée (développant). Après migration, les chromatogrammes sont séchés puis révélés à l’aide d’une solution éthanolique de DPPH (0,6 mg / mL). Les constituants de l’extrait présentant une activité anti radicalaire potentielle sont révélés sous forme de spots jaune-pâle sur fond violet après 5 min de temps optimal, Les composés piégeurs du radical libre DPPH ont été obtenus par comparaison avec les plaques CCM élaborées lors du criblage phytochimique.
Evaluation de l’effet gastro-protecteur : Les souris de poids variant entre 26 à 30 g ont été placées dans des cages puis réparties en neuf (9) lots de six (4) avec un accès libre à l’eau de robinet et à l’alimentation de type bouchon. Les conditions de température stable (25-27°C) et un cycle de lumière de 12 heures par jour ont été respectés. Les souris ont été mises à jeun 24 h avant le début de l’expérience alors que l’eau a été retirée 1h avant expérimentation. Chaque lot a reçu par voie orale les solutions suivantes :
Lot 0 (témoin négatif) : uniquement que de l’eau distillée
Lot 1 (témoin positif) : NaCl 0,9% (eau physiologique)
Lot 2 (référence) : Oméprazole 30 mg / kg
Lot 3 (référence) : Sucralfate 30 mg / kg
Lot 4 et 5 : Extrait décocté 100 mg / kg pour le Lot 4 et 200 mg / kg pour le Lot 5
Lot 6 et 7 : Extrait macéré aqueux 100 mg / kg pour le Lot 6 et 200 mg / kg au le Lot 7
Lot 8 et 9 : Extrait hydroéthanolique 100 mg / kg pour le Lot 8 et 200 mg / kg au le Lot 9
Une heure après l’administration des différentes solutions, 0,3 mL d’éthanol 96 % est administré à toutes les souris sauf ceux du lot 0. Les souris ont été sacrifiées une heure après l’administration de l’éthanol 96 % puis l’estomac de chaque souris a été prélevé et ouvert à l’aide d’une paire de ciseaux suivant la grande courbure. L’estomac est ensuite lavé avec une solution d’eau physiologique (NaCl 0,9%) et étalé sur une tablette pour l’observation à l’œil nu des ulcérations formées. Les ulcérations ont été comptabilisées selon les méthodes décrites par Coulidiati et al. (2019). La longueur de chaque ulcération a été mesurée à l’aide d’une règle graduée en millimètre (mm) et la gravité des ulcères ont été déterminées selon un score allant de 0 à 7. Ainsi, 0 = pas de lésion ; 1 = 1 à 3 petites lésions (PL) ; 2 = 4 à 10 petites lésions (PL) ; 3 = 10 PL à 3 lésions moyennes (LM) ; 4 = 4 à 6 lésions moyennes (LM) ; 5 = 5 LM à 3 grandes lésions (GL) ; 6 = 4 à 6 grandes lésions (GL) ; 7 = plus de 7 grandes lésions (GL). PL < 2mm, LM : 2 à 4 mm, GL > 4 mm
L’indice d’ulcération (IU) et le pourcentage de protection ont été estimés selon les formules suivantes.
UI = (Nombre d’ulcère grade 1) ×1 + (Nombre d’ulcère grade 2) ×2 + (Nombre d’ulcère grade 3) × 3
PP = [(UI témoin – UI prétraité) / UI témoin] x 100
Analyses statistiques des résultats : Les résultats ont été analysés à l’aide du logiciel satistica version 7.1 et Microsoft Excel 2010. Toutes les données ont été exprimées sous forme de moyenne ± écart type. La significativité des différences entre les groupes traités et témoins a été évalués par le test de Fischer réalisé au seuil de 5%. Les différences étaient considérées significatives pour p < 0,05.
RESULTATS
Détection des phytocomposés : Les tableaux 1 à 4 présentent les phytocomposés présents dans les fractions éthylacétatique et dichlorométhane de Mitragyna inermis. La fraction acétatique contient des tanins et acide phénolique avec une majorité aux acides phénoliques. Quant à la fraction au dichlorométhane, elle a renfermé des flavonoïdes, des alcaloïdes et des coumarines. Dans le visible, les chromatoplaques ont présenté des spots de couleurs variables caractéristiques des groupes de molécules mis en évidence. Avec les flavonoïdes deux spots se sont distingués de couleurs vertes aux rf= 0,81 et 0,95 (tableau 2). Les coumarines ont été détectés dans le visible comme à l’UV ( 366 nm) figure 3. A l’UV, une coloration bleue caractéristique des coumarines a été observé avec l’extrait MA2 à rf= 0,95 et avec l’extrait MD2 aux rf= 0,25 ; 0,76 et 0,86 (tableau 5).
Tableau 1 : Détection des tanins et acides phénoliques dans la fraction éthylacétatique avec le développant CH2Cl2/AcOEt/ CH3COOH (1 :3,5 :1) (V : V : V)
| Extraits | Rf (Couleur au visible) : Composé possible |
| MA | 0.95 (gris) : tanins ; 0,45 (Vert) : Acide phénolique ; 0,27 (Vert) : Acide phénolique ; 0,06 (Vert) : Acide phénolique ; 00 (Vert) : Acide phénolique |
| ME | 0,97 (Gris) : Tanin ; 0,72 (Gris) : Tanin ; 0,27 (Vert) : Acide phénolique ; 0,06 (Vert) : Acide phénolique ; 00 (Vert) : Acide phénolique ; |
| MD | 0,95 (Gris) : Tanin ; 0,76 (Vert) : Acide phénolique ; 0,65 (Gris) : Tanin ; 0,52 (Vert) : Acide phénolique ; 0,4 (Gris) : Tanin ; 0,3 (Vert) : Acide phénolique ; 0,18 (Gris) : Tanin ; 0,13 (Vert) : Acide phénolique |
MA3 : Extrait Aqueux ; ME3 : Extrait Ethanolique ; MD3 : Extrait Décocté
Tableau 2 : Détection des flavonoïdes dans la fraction Dichlorométhane avec le développant CH2Cl2/AcOEt/ C6H14 (3 :4 :2) (V : V : V)
| Extraits | Rf (Couleur au visible) : Composé possible |
| MA | 0,38(Jaune) : flavonoïde ; 0,3(Jaune) : flavonoïde ; 0,2(Jaune,) : flavonoïde ; 0,1(Jaune,) : flavonoïde |
| ME | 0,95 (Vert) : flavonoïde ; 0,81(Vert) : flavonoïde ; 0,71(Jaune) : flavonoïde ; 0,3(Jaune) : flavonoïde ; 0,2(Jaune) : flavonoïde 0,1(Jaune) : flavonoïde |
| MD | 0,93(Jaune) : flavonoïde ; 0,82(Jaune) : flavonoïde ; 0,7(Jaune) : flavonoïde |
Tableau 3 : Détection des alcaloïdes dans la fraction Dichlorométhane avec le développant CH2Cl2/AcOEt/ C6H14 (2 :2 :1) (V : V : V)
| Extraits | Rf (Couleur au visible) : Composé possible |
| MA | 0,97(orange) : alcaloïde ; 0,88(orange) : alcaloïde |
| ME | 0,97(orange) : alcaloïde |
| MD | 0,97(orange) : alcaloïde ; 0,88(orange) : alcaloïde 0,81(orange) : alcaloïde |
Tableau 4 : Détection des coumarines dans la fraction Dichlorométhane avec le développant CH2Cl2/AcOEt/ C6H14 (2 :2 :1) (V : V : V)
| Extraits | Rf (Couleur au visible, couleur à l’UV) : Composé possible |
| MA | 0,97(Jaune, Ab) : Coumarine ; 0,95(Ab, bleu) : Coumarine ; 0,76(Ab, Jaune) : Coumarine , 0,65(Ab, Jaune) : Coumarine ; 0,56(Jaune, Ab) : Coumarine ; 0,46(Jaune, Ab) : Coumarine ; 0,35(Jaune, Ab) : Coumarine |
| ME | 0,97(Jaune, Ab) : Coumarine ; 0,92(Jaune, Ab) : Coumarine ; 0,85(Jaune, Ab) : Coumarine ; 0,85(Ab, Jaune) : Coumarine ; 0,76(Jaune, Ab) : Coumarine ; 0,73(Ab, Jaune) : Coumarine ; 0,73(Jaune, Ab) : Coumarine ; 0,6(Ab, Jaune) : Coumarine ; 0,6(Jaune, Ab) : Coumarine ; 0,5(Ab, Jaune) : Coumarine |
| MD | 0,95(Jaune, Ab) : Coumarine ; 0,85(Jaune, Ab) : Coumarine ; 0,72(Jaune, Ab) : Coumarine ; 0,86(Ab, bleue) : Coumarine ; 0,76(Ab, bleue) : Coumarine ; 0,72(Ab, bleue) : Coumarine ; 0,25(Ab, bleue) : Coumarine. |
L’ultra-Violet ( 366 nm)
Figure3 : Détection des coumarines dans la fraction au Dichlorométhane
Pouvoir inhibiteur du radical DPPH par CCM : L’activité antioxydante des extraits s’est caractérisé par des tâches jaunes crème sur fond violet. Les résultats des différents tableaux 5, 6, 7, 8 ont montré l’activité antiradicalaire des phytocomposés présents dans les extraits totaux de la plante étudiée. L’analyse des profils CCM, des différents tableaux ont montré que les tanins, les acides phénoliques, les coumarines, les flavonoïdes et les alcaloïdes ont été responsables de l’activité antiradicalaire des extraits de Mitragyna inermis figure 4. Toutefois, des spots non identifiés (NI), lors du criblage phytochimique ont des propriétés inhibitrices du radical DPPH. Une observation générale des plaques CCM a indiqué qu’il existe un nombre élevé de composés non identifiés (NI) responsables de l’activité antioxydante des extraits étudiés.
Tableau 5 : Phytocomposés (tanins et acide phénoliques) piégeurs du DPPH
| Extraits | Rf (Couleur au visible) : Composé possible |
| MA | 0,97(Jaune) : NI ; 0,95(Jaune) : tanins ; 0,82(Jaune) : NI ; 0,76(Jaune) : NI ; 0,47(Jaune) : tanins ; 0,37(Jaune) : NI ; 0,27(Jaune) : tanins ; 0,16(Jaune) : NI ; 0,06(Jaune) : tanins |
| ME | 0,97(Jaune) : tanins ; 0,87(Jaune) : NI ; 0,72(Jaune): tanins ; 0,27(Jaune): Acide phénolique |
| MD | 0,95(Jaune) : tanins ; 0,76(Jaune): Acide phénolique ; 0,65(Jaune): tanins ; 0,52(Jaune): Acide phénolique ; 0,4(Jaune): tanins ; 0,3(Jaune) : Acide phénolique ; 0,18(Jaune): tanins |
Tableau 6 : Phytocomposés (Coumarines) piégeurs du DPPH
| Extraits | Rf (Couleur au visible) : Composé possible |
| MA | 0,95(Jaune): coumarine ; 0,86( Jaune ): coumarine ; 0,76(Jaune): NI ; 0,65(Jaune): NI ; 0,56(Jaune): coumarine ; 0,46(Jaune): coumarine ; 0,28(Jaune): coumarine ; 0,12(Jaune) : coumarine |
| ME | 0,92(Jaune): coumarine ; 0,85( Jaune ): coumarine ; 0,76(Jaune): coumarine ; 0,6(Jaune): coumarine ; 0,5( Jaune ): coumarine ; 0,4(Jaune): coumarine ; 0,35(Jaune): coumarine |
| MD | 0,95(Jaune): coumarine ; 0,86( Jaune ): coumarine ; 0,76(Jaune): coumarine |
Tableau 7 : Phytocomposés (flavonoïdes) piégeurs du DPPH
| Extraits | Rf (Couleur au visible) : Composé possible |
| MA | 0,38(Jaune): flavonoïdes ; 0,3(Jaune): flavonoïdes ; 0,2(Jaune) : flavonoïdes ; 0,1(Jaune): flavonoïdes ; 00(Jaune): flavonoïdes |
| ME | 0,95(Jaune): NI ; 0,71(Jaune): NI ; 0,3(Jaune): flavonoïdes ; 0,2(Jaune) : flavonoïdes ; 0,1(Jaune): flavonoïdes |
| MD | 0,93(Jaune): flavonoïdes ; 0,82(Jaune): flavonoïdes 0,7(Jaune): flavonoïdes ; 0,65(Jaune): NI ; 00(Jaune): flavonoïdes |
Tableau 8 : Phytocomposés (Alcaloïdes) piégeurs du DPPH
| Extraits | Rf (Couleur au visible) : Composé possible |
| MA | 0,97(Jaune): alcaloïdes ; 0,88(Jaune): NI |
| ME | 0,97(Jaune): alcaloïdes ; 0,86(Jaune): NI |
| MD | 0,97(Jaune): alcaloïdes ; 0,88(Jaune): alcaloïdes 0,65(Jaune): alcaloïdes ; 0,52(Jaune): NI |
| Tanins et acides phénoliques |
| Coumarines |
Figure 4 : Dépistage des potentialités antiradicalaire
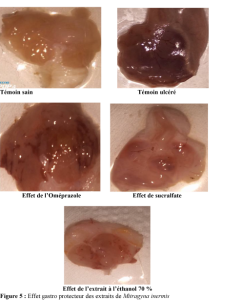
Effet gastro-protecteur :Les photos de la figure 5 présentent les états de la muqueuse gastrique des souris expérimentales après protection de celle-ci par les extraits et les molécules de références. La comparaison d’indice d’ulcérations et du pourcentage de protections ont permis d’évaluer l’effet gastro-protecteur des extraits bruts de Mitragyna inermis contre les lésions induites par l’éthanol 96 % (tableau 9). Les lots traités avec les extraits de M. inermis aux doses de (100 et 200 mg / kg) ont obtenu des indices d’ulcérations allant de 6,00 ± 2,00 % à 35,00 ± 3,61 % ces indices sont faibles comparativement à celui du témoin positif (83,33±6,03). Les plus faibles indices d’ulcérations ont été obtenu avec l’extrait éthanolique (100 mg / kg) et le sucralfate (30 mg / kg). Ces substances ont obtenu respectivement des indices de 6,00 ± 2,00 et 8,25 ±2,15. A ces faibles indices correspondent les pourcentages de protection les plus grand allant de (90,09 ±2,31 (sucralfate 30 mg / kg) à. 92,84 ± 2,20 % (l’extrait éthanolique (100 mg / kg). Ces valeurs étaient proches de celle du témoin négatif (100 %). Des comparaisons statistiques multiples ont montré qu’il n’existe pas de différences significatives entre le pourcentage de protection des lots témoins (lots 0) et traités (lots 3 et 7).
Tableau 9 : Indice d’ulcération et pourcentage de protection des extraits
| Extraits | Lots | Dose (mg/kg) | Indice d’ulcération | Pourcentage de protection |
| Témoin négative (H2O) | Lot 0 | —- | 0,00 ± 0,00 a | 100,00 ± 0,00 a |
| Témoin positive (éthanol 96%) | Lot 1 | —- | 83,33±6,03 d | —– |
| Oméprazole | Lot 2 | 30 | 20,00 ± 2,65 b | 75,92 ± 3,56 b |
| Sucralfate | Lot 3 | 30 | 8,25 ±2,15a | 90,09 ±2,31a |
| Extrait décocté | Lot 4 | 100 | 35,00 ± 3,61 c | 57,93 ± 4,13 d |
| Lot 5 | 200 | 27,67 ± 6,03 bc | 66,87 ± 6,42 bcd | |
| Extrait Aqueux | Lot 6 | 100 | 33,33 ± 1,15 c | 63,95 ± 4,03 cd |
| Lot 7 | 200 | 24,00 ± 3,00 bc | 71,20 ± 2,91 bc | |
| Extrait éthanolique | Lot 8 | 100 | 6,00 ± 2,00 a | 92,84 ± 2,20 a |
| Lot 9 | 200 | 27,67 ± 5,13 bc | 66,91 ± 4,78 bcd |
(a,b,c,d): constituent les différentes classes statistiques des pourcentages de protection
Témoin sain Témoin ulcéré
Effet de l’Oméprazole Effet de sucralfate
Effet de l’extrait à l’éthanol 70 %
Figure 5 : Effet gastro protecteur des extraits de Mitragyna inermis
Mitragyna inermis, est une plante reconnue pour ces nombreuses prescriptions en médecine traditionnelle. Elle est impliquée dans plusieurs recettes notamment, contre le paludisme (Adama et al., 2016), céphalée, douleur abdominale, douleur générale et rhumatisme (Dembele 2020). Le profil phytochimique par chromatographie sur couche mince des extraits de feuilles de cette plante a montré la présence en nombre élevé de tanins, flavonoïdes, coumarine et d’acide phénolique mais un nombre modéré d’alcaloïdes. Ces résultats étaient similaires à ceux de Konkon et al. (2020). Ces auteurs ont montré que les polyphénols, les flavonoïdes et les tanins catechiques étaient présents dans les extraits méthanolique, infusés et décoctés mais absents dans l’extrait chloroformique des feuilles de M. inermis. La chromatographie sur couche mince a révélé la présence de plusieurs types de molécules à travers plusieurs spots à des Rf variés. Ce profil phytochimique était également comparable à celui rapporté par Coulidiati et al. (2019) lors des travaux sur Acacia nilotica. Les tanins, les flavonoïdes, les coumarines, les acides phénoliques et les alcaloïdes révélés, sont reconnus pour diverses propriétés biologiques inhérentes aux plantes végétales. La forte présence de ces composés, pourrait donc justifier l’intérêt porté à cette plante en milieu traditionnel. La présente étude a également montré les potentialités antiradicalaires des extraits de M. inermis. Cette potentialité est liée aux tanins, aux acides phénoliques, aux flavonoïdes et aux coumarines. La littérature scientifique rapport que la présence de composés phytochimiques dans les extraits de plantes est responsable de leur capacité à piéger les radicaux libres (Bouchama et al., 2023). En effet ces composés phytochimiques disposent d’un grand nombre de groupes hydroxyle et carboxyle, qui peuvent se lier aux radicaux libres et les neutraliser (Bouchama et al., 2023). Ils sont également réputés pour leurs propriétés à céder un électron ou un atome d’hydrogène aux radicaux libres non appariés (Gurung et al., 2020). La présence de ces composés polyphénoliques a conféré à cette plante les propriétés antioxydantes avérés. S’agissant de L’effet gastro protecteur des extraits, il a été évalué en utilisant l’éthanol 96 % l’un des ulcérogènes les plus utilisés dans l’investigation préclinique des propriétés antiulcéreuses des substances (Coulidiati et al., 2019). L’éthanol conduit à une hémorragie, un œdème, une accumulation massive de calcium, la production des radicaux libres et l’inhibition de la synthèse des prostaglandines (Noor et al., 2017). Plusieurs travaux de recherche ont montré que des lésions gastriques peuvent survenir en raison d’une surproduction d’espèces réactives de l’oxygène et d’une inflammation accrue (Danisman et al., 2023). Ces différents éléments sont des précurseurs du stress oxydatif. Par conséquent, le contrôle de la production des espèces réactives de l’oxygène et de la réaction inflammatoire est essentiel pour éviter l’ulcère gastrique. Une plante ayant une bonne activité antioxydante pourrait avoir donc des propriétés gastro protecteur intéressant. Les macérés éthanolique, aqueux et le décocté des extraits de la plante étudiée, administrés par voie orale à des doses différentes, ont protégé la muqueuse gastrique des souris contre les ulcérations provoquées par l’éthanol 96 %. Dans nos conditions expérimentales, l’extrait éthanolique a présenté une meilleure protection de la muqueuse gastrique comparativement aux autres extraits et les molécules standards (l’oméprazole et le sucralfate), aux doses utilisées. Ces résultats corroborent ceux de Bouchama et al. (2023). Ces auteurs ont montré que l’extrait aqueux de Teucrium polium s’est avérée assez similaire à l’omeprazole, un médicament gastro protecteur standard. L’effet gastro protecteur de notre plante pourrait être lié à la forte activité antioxydante des extraits car, les substances possédant un potentiel antioxydant ont des effets gastro-protecteur intéressant (Neto et al., 2017).
CONCLUSION ET APPLICATION DES RESULTATS
Cette étude a permis d’établir une base scientifique de l’utilisation de Mitragyna inermis, une plante très utilisée en médecine traditionnelle en Côte d’Ivoire. Elle a révélé que les extraits de M. inermis renferment un grand nombre de composés phytochimiques, possèdent un pouvoir gastro-protecteur significatif et une activité antioxydante intéressante. Cette activité protectrice a montré une forte diminution des agressions dues à l’éthanol 96% par l’extrait éthanolique à la concentration de 100 mg/ kg. L’activité gastro-protectrice observée est probablement due au potentiel antioxydant, elle-même liée aux composés phytochimiques présents dans les extraits de la plante. Cette étude a montré que l’extrait éthanolique à la concentration de 100 mg/ kg a une action de protection similaire à celle du sucralfate (30 mg/kg) mais protège mieux la muqueuse gastrique que l’Oméprazole (30 mg/kg), un antiacide de premier choix. Des études de toxicité sont nécessaires afin d’envisager la mise en place de phytomédicament à partir des extraits de feuilles de cette plante.
Conflit d’intérêt
Les auteurs affirment n’avoir aucun conflit d’intérêt avec la publication de ce manuscrit
Contribution des auteurs
Ce travail a été réalisé en collaboration avec tous les auteurs. Tous les auteurs ont lu et approuvé le manuscrit final.
RÉFÉRENCES BIBLIOGRAPHIQUES
Bouchama M, Djidjeli E, Kemmouche C. Effets Antioxydant et gastro protecteur de l’extrait aqueux de la plante médicinale Teucrium polium sur les lésions de la muqueuse gastrique. Mémoire de Master, toxicologie. Université Frères Mentouri Constantine. République Algérienne Démocratique et Populaire. 2023 ; 116p
Serafim C, Araruna ME, Junior EA, Diniz M, Hiruma-Lima C, Batista L. A Review of the Role of Flavonoids in Peptic Ulcer. Molecules. 2020 ; 25 (22) :1-32 DOI : 10.3390/molecules25225431
Doffou AS, Kouamé GD, Bangoura AD, Yaogo A, Méité M, Kissi H, et al. Prévalence des Ulcères Gastroduodénaux et des Lésions Précancéreuses Gastriques au cours de la Gastrite Chronique à Helicobacter Pylori selon le Système de Sydney : À Propos de 52 Cas. Health Sci. Dis. 2020 ; 21 (3) : 16-20
Werme K, Cyrille B, Issiaka O, Albert TY, Djénèba O, Florencia D. Diagnostic moléculaire d’helicobacter pylori par PCR chez les patients en consultation gastroentérologique au Centre Médical Saint Camille de Ouagadougou. Pan African Medical Journal. 2015 ; 21 :1-6 doi :10.11604/pamj.2015.21.123.6001
Yousef A-A, David CM, Colin WH. Potassium-competitive acid blockers for the treatment of acid-related disorders. Aliment Pharmacol Ther. 2021 ; 53(7) :794-809 DOI : 10.1111/apt.16295
Laine L, Kenneth DV, Philip K, Stefan M, John L, Barbara H, et al. Vonoprazan Versus Lansoprazole for Healing and Maintenance of Healing of Erosive Esophagitis: A Randomized Trial. Gastroenterology. 2023 ; 164(1) :61-71 DOI: 10.1053/j.gastro.2022.09.041
Koyyada A. Long-term use of proton pump inhibitors as a risk factor for various adverse manifestations. Therapie. 2021 ; 76(1) :13-21 DOI: 10.1016/j.therap.2020.06.019
Konkon NG, Adjoungoua AL, Manda P, Simaga D, N’Guessan KE, Kone BD. Etude phytochimique de Mitragyna inermis (Willd.) Kuntze (Rubiaceae), plante a feuille antidiabétique. Pharm. Méd. Trad. Afr. 2006, Vol. XIV, pp. 73-80
Kerharo J, Adams JG. La pharmacopée sénégalaise traditionnelle plantes médicinales et toxiques, Edition Vigot et frères, Paris. 1974 ;1011 p
Toklo PM, Yayi-Ladekan E, Sakirigui A, Assogba FM, Alowanou GG, Ahomadegbe MA, et al. Phytochemistry and pharmacological review of Mitragyna inermis (Willd.) Kuntze (Rubiaceae). Journal of Pharmacognosy and Phytochemistry. 2020 ; 9(2) : 22-30
Zirihi GN, Kra AKM, Bahi C, Guédé-Guina F. Evaluation of the antifungal activity of Microglossa pirifolia (Lamarck) O. Kuntze (Asteraceae) “PYMI” on the in vitro growth of candida albicans. Journal of Medicine and African Pharmacopoeia, 2003 ; 17 : 11-18.
Korpe DA, Iseri D, Sahin FI, Cabi E, Habiral M. High-antibacterial activity of Urtica spp. seed extracts on food and plant pathogenic bacteria. International Journal of Food Sciences and Nutrition. 2013 ; 64(3) :355-62 DOI: 10.3109/09637486.2012.734290
Ouattara LH, Kabran MGR, Kadja AB, Tano BM, Mamyrbekova JA, Bekro YA. Etude phytochmique et activité antioxydante d’extraits de plantes de Côte d’Ivoire utilisées dans le traitement traditionnel des hémorroïdes. Internationnal Journal of Innovation and Applied Studies. 2016 ; 15(4) : 881-893.
Takao T, Kitatani F, Watanabe N, Yagi A, Sakata K. A simple screening method for antioxidant and isolation of several antioxidants produced by marine bacteria from fish and shell fish. Brusci. Brotech-Brochem. 1994 ; 58 : 1780-1783
Coulidiati KVN, Ouedraogo L, Belemnaba M, Nitiema M, Gambo AGG, Ouedraogo KT, et al. Effet gastroprotecteur et potentiel mécanisme d’action antiulcéreuse d’extraits de fruits de Acacia nilotica var adansonii (Guill. et Perr.) O. Ktze (Mimosaceae) Sciences et technique. 2019 ; 42 : 121-135
Adama D, Koffi K, Haidara M, Togola A, Sanogo R, Essien K, et al. Activité analgésique de quatre plantes utilisées dans la prise en charge traditionnelle du paludisme au Mali et au Togo. International Journal of Biological and Chemical Sciences. 2016 ; 10 : 1342-1349 DOI : http://dx.doi.org/10.4314/ijbcs.v10i3.34
Dembele Z. Etat de lieux plantes médicinales utilisées dans le traitement traditionnel de la douleur au Mali. Thèse de doctorat. Université des sciences des techniques et des technologies de Bamako. République du Mali. 2021 ; 121p
Gurung R. Preliminary phytochemical screening, total phenol and Flavonoid content of Mimosa rubicaulis and Reinwardita indica. International Journal of Pharmacy and Pharmaceutical Sciences. 2020 ; 12 : 54-8 DOI: https://doi.org/10.22159/ijpps.2020v12i1.35914
Noor WIS, Ahmad KNA, Norhafizah M, Maizatul HO, Siti FMT, Manraj SC, et al. Semipurified Ethyl Acetate Partition of Methanolic Extract of Melastoma malabathricum Leaves Exerts Gastroprotective Activity Partly via Its Antioxidant-Antisecretory-AntiInflammatory Action and Synergistic Action of Several Flavonoid-Based Compounds. Oxidative Medicine and Cellular Longevity. 2017 ; 1-14 DOI: https://doi.org/10.22159/ijpps.2020v12i1.35914
Danisman B, Cicek B, Yildirim S, Bolat I, Kantar D, Golokhvast KS, et al. Carnosic Acid Ameliorates Indomethacin-Induced Gastric Ulceration in Rats by Alleviating Oxidative Stress and Inflammation. Biomedicines. 2023 ; 11(3) :1-14 https://doi.org/10.3390/biomedicines11030829
Neto LJdL, Andreza GBR, Valterlucio SS, Severino DGS, Antonia TLdS, Larissa RdO, et al. Gastroprotective and ulcer healing effects of hydroethanolic extract of leaves of Caryocar coriaceum: Mechanisms involved in the gastroprotective activity. Chemico-Biological Interactions. 2017 ; 261 : 56-62 DOI: 10.1016/j.cbi.2016.11.020